La Fosforilazione Ossidativa
La fosforilasi ossidativa rappresenta il punto finale del metabolismo energetico degli organismi aerobici. Tutte le tappe degradative dei carboidrati, amminoacidi e degli acidi grassi terminano in quest’ ultima tappa della respirazione cellulare in cui l’ energia prodotta dalle ossidazioni viene utilizzata per sintetizzare ATP. Negli eucarioti la fosforilazione ossidativa avviene nei mitocondri e grazie al NADH e al FADH2 si verifica la riduzione dell’ ossigeno ad acqua mediante anche ad una serie di trasportatori di elettroni associati alla membrana mitocondriale interna.
Il mitocondrio ha due membrane : la membrana mitocondriale esterna è facilmente permeabile a piccole molecole e ioni che si muovono liberamente attraverso canali transmembrana formati da una famiglia di proteine integrali dette porine. La membrana mitocondriale interna invece è impermeabile alle molecole di piccole dimensioni e a quasi tutti gli ioni compresi gli ioni H+ mentre è permeabile all’acqua all’ ossigeno e all’ anidride carbonica e ad altri composti che usano trasportatori specifici. In essa sono localizzati i componenti della catena respiratoria e il complesso dell’ ATP sintasi che sintetizza ATP. La matrice mitocondriale contiene invece il complesso della piruvato deidrogenasi e gli enzimi del ciclo dell acido citrico, della beta ossidazione e dell ossidazione degli amminoacidi.
La fosforilazione ossidativa ha inizio con l’ ingresso degli elettroni nella catena dei trasportatori di elettroni, chiamata catena respiratoria. La maggior parte di questi elettroni derivano dall’ azione delle deidrogenasi che li hanno raccolti nei processi catabolici e poi incanalati verso gli accettori universali di elettroni come i nucleotidi piridinici NAD+ o NADP+ o le flavoproteine come FAD o FMN
Le deidrogenasi NAD+ dipendenti rimuovono due atomi di idrogeno dai loro substrati. Uno di questi viene trasferito sotto forma di ione idruro il quale trasporta quindi due elettroni, mentre l'altro atomo di idrogeno viene rilasciato nell'ambiente circostante sotto forma di ione H+. Il NAD+ può ricevere gli elettroni dal NADPH il quale a sua volta ha ricevuto gli elettroni mediante una deidrogenasi NADP dipendente. La reazione di passaggio degli elettroni dal NADPH al NAD+ è catalizzata dalla piridina nucleotide transidrogenasi.
Le flavoproteine contengono un cofattore flavinico, l’FMN oppure il FAD legato saldamente. Questo coenzima può accettare un elettrone oppure 2.
La catena respiratoria mitocondriale è formata da una serie di trasportatori di elettroni, la maggior parte dei quali sono proteine integrali di membrana contenenti gruppi prostetici e in grado di donare o accettare uno o due elettroni. Oltre al NAD o al FAD nella catena respiratoria agiscono altri 3 gruppi di trasportatori di elettroni: l’ ubichinone (coenzima Q), i citocromi e le proteine ferro-zolfo.
Nel particolare:
- coenzima Q: detto anche ubichinone è un benzochinone con una catena laterale isoprenoide, rappresenta il punto di raccolta iniziale degli elettroni provenienti dai coenzimi ridotti FADH2 e NADH. Esso può accettare un elettrone trasformandosi in un radicale o può accettare due elettroni acquistando la sua forma ridotta diventando ubichinolo. Poichè è idrofobico il coenzima Q si può diffondere nel doppio strato lipidico della membrana mitocondriale interna.
- i citocromi: sono delle proteine con un gruppo prostetico ferro-protoporfirinico. Nei mitocondri sono presenti 3 classi di citocromi : A-B-C. Il gruppo eme dei citocromi di tipo A e B è saldamente legato alla proteina ma senza legami covalenti, mentre il gruppo eme C dei citocromi di tipo C è legato covalentemente alla proteina mediante ponti tioeteri a due residui di cisteina. L’ eme B presente nei citocromi B è lo stesso di quello presente nella mioglobina e nell’ emoglobina. L ‘ eme A contenuto nei citocromi di tipo A è caratterizzato da una lunga catena isoprenoide legata ad uno degli anelli a 5 membri (anelli pirrolici), inoltre ha un gruppo metile ossidato a un gruppo formile (CHO). I citocromi di tipo A e B sono proteine integrali della membrana mitocondriale interna, mentre il citocromo c dei mitocondri si lega mediante interazioni elettrostatiche alla superficie esterna della membrana mitocondriale interna
- le proteine ferro-zolfo: sono proteine che contengono ferro associato ad atomi di zolfo inorganico o atomi di zolfo di residui di cisteina della proteina. Questi centri ferro-zolfo possono avere strutture molto semplici come un singolo atomo di ferro coordinato con 4 atomi di zolfo di catene laterali di residui di cisteina oppure possono essere più complesse e contenere 2 o 4 atomi di ferro. Queste proteine partecipano a reazioni redox, in cui viene trasferito un elettrone alla volta, utilizzando modificazioni dello stato di ossidazione del ferro.
Questi trasportatori di elettroni sono organizzati in 4 complessi intermembrana. Ciascuno di essi è in grado di trasportare elettroni e può essere considerato come una parte della catena respiratoria.
1° complesso
Questo complesso è detto anche NADH ubichinone ossidoreduttasi, è un enzima di grandi dimensioni contenente più di 42 catene polipeptidiche diverse fra cui una flavoproteina contenente FMN e 6 centri ferro-zolfo. Tale complesso ha la forma di una L con un braccio immerso nella membrana mitocondriale interna e l'altro orientato verso la matrice.
Esso catalizza il trasferimento di due elettroni sotto forma di ione idruro dal NADH e di un protone dal solvente acquoso della matrice al coenzima Q, inoltre catalizza il trasferimento di 4 protoni dalla matrice allo spazio intermembrana, il complesso 1 funge quindi da pompa protonica guidata dall energia derivante il trasferimento di elettroni. Una pompa protonica è una proteina integrale di membrana capace di spostare protoni attraverso la membrana un mitocondrio. Lo ione idruro viene prima trasferito dal NADH alla FMN, da qui i due elettroni si muovono attraverso una serie di centri Fe-S giungendo all ubichinone che viene ridotto ad ubichinolo (QH2) il quale si diffonde all’interno della membrana mitocondriale interna dal complesso I al III. Per ogni coppia di elettroni si ha l’espulsione di 4 protoni dalla matrice. Il flusso protonico produce un potenziale elettrochimico tra i due lati della membrana interna creando un lato positivo rappresentato dallo spazio intermembrana e un lato negativo invece rappresentato dalla matrice. La sintesi di ATP sarà possibile proprio grazie a questo potenziale elettrochimico.
2° complesso
Il complesso 2 è detto anche succinato deidrogenasi ed appartiene al ciclo dell acido citrico, è l unico enzima di tale ciclo ad essere legato alla membrana mitocondriale interna. Il complesso oltre ad essere costituito dalla succinato deidrogenasi presenta FAD e centri Fe-S. Tale complesso trasferisce gli elettroni che derivano dall’ ossidazione del succinato al FAD che viene ridotto a FADH2, da qui gli elettroni attraverso centri Fe-S giungono al coenzima Q. Altri substrati di deidrogenasi mitocondriali passano i loro elettroni alla catena respiratoria a livello del coenzima Q ma non attraverso il complesso 2. La prima tappa della beta ossidazione è catalizzata dalla flavoproteina acil-CoA deidrogenasi in cui si ha il trasferimento di due elettroni al FAD, gli elettroni poi passano alla flavoproteina detta ETF e infine alla ETF ubichinone ossidoreduttasi che cede gli elettroni riducendo il coenzima Q. il glicerolo 3 fosfato ,prodotto dal glicerolo rilasciato nella degradazione degli acidi grassi, viene ossidato dalla glicerolo 3 fosfato deidrogenasi. Questa è una flavoproteina localizzata sulla faccia esterna della membrana mitocondriale interna e trasferisce gli elettroni all ubichinone.
3° complesso
Questo complesso è detto anche ubichinone: citocromo c ossidoreduttasi. Trasferisce gli elettroni dall’ ubichinolo (QH2) al citocromo C con il trasporto di protoni dalla matrice allo spazio intermembrana.
Il trasferimento di elettroni avviene attraverso un ciclo dell’ ubichinone.
Una molecola di ubichinolo si lega ad un sito del complesso III posto vicino allo spazio intermembrana detto sito Qp. Questa molecola rilascia due elettroni uno viene donato al citocromo c1, un altro tramite il citocromo B giunge ad una molecola di ubichinone legata al sito Qn posto vicino alla matrice mitocondriale. La molecola di ubichinone legata al sito Qn in questo modo si trasforma in un radicale semi ridotto. Per ridurre completamente questa molecola si verifica l'ossidazione di una seconda molecola di ubichinolo che compie le stesse tappe della precedente. Per la riduzione inoltre servono due protoni prelevati dalla matrice mitocondriale. Per ogni molecola di ubichinolo ossidata ad ubichinone vengono rilasciati nello spazio intermembrana due protoni quindi in totale verranno rilasciati 4 protoni. In questo ciclo due molecole di ubichinolo vengono consumate ma ne viene prodotta una. I 2 elettroni che sono stati ceduti al citocromo C1 passano al citocromo C che non fa parte del complesso
4° complesso
Nella tappa finale della catena respiratoria il complesso 4 detto anche citocromo ossidasi trasporta gli elettroni dal citocromo C all’ ossigeno molecolare riducendolo a H2O. Esso catalizza il trasferimento di 4 elettroni provenienti da 4 molecole di citocromo c diverse all’ ossigeno per formare 2 molecole d acqua, il processo consuma 4 ioni H+ dalla matrice. Inoltre il complesso utilizza l’energia di questa reazione per pompare un protone nello spazio intermembrana per ogni elettrone che lo attraversa aumentando ulteriormente il potenziale elettrochimico prodotto del complesso 1 e il complesso 3.
Il pompaggio di protoni nello spazio intermembrana determina una energia elettrochimica dovuta alla differenza di cariche e alla differenza di concentrazione di ioni H+, questa energia viene conservata in un gradiente protonico detto forza motrice protonica.
La sintesi dell’ ATP
Secondo Peter Mitchell che propose il modello chemiosmotico la forza motrice protonica porta alla sintesi di ATP quando il flusso protonico inverte la sua direzione e i protoni ritornano nella matrice attraverso un canale protonico associato all’ ATPsintasi.
L’ ATPsintasi catalizza la sintesi dell’ ATP da ADP + P accoppiata al flusso protonico dallo spazio intermembrana alla matrice. Questo complesso enzimatico situato nella membrana mitocondriale interna è costituito da due componenti F1 e F0.
- F1:è una proteina estrinseca di membrana rivolta verso la matrice mitocondriale dissociabile dalla F0, ed è solubile in acqua. Quando la F1 è isolata perde la capacità di sintetizzare ATP e acquista la capacità inversa di idrolizzare ATP per formare ADP e P.
- F0:è un canale protonico transmembrana collegato da uno stelo alla componente F1, ed è insolubile.
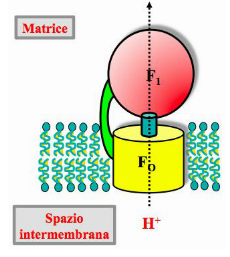
Il complesso F1 è costituito da diverse subunità di cui 3α,3β,1γ 1δ e 1ε.
E’ composto da un’ alternanza di subunita alfa e beta disposte come gli spicchi di un arancia. Ciascuna subunità beta ha un sito catalitico per la sintesi dell’ ATP. La subunità y forma un asse centrale che attraversa tutto il complesso F1. Anche se le sequenze amminoacidiche delle 3 unità beta sono identiche, queste differiscono per la loro conformazione in parte a causa dell associazione della subunità gamma con solo una delle 3 beta.
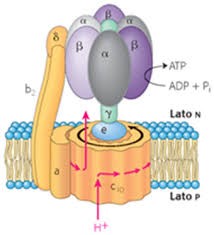
Il complesso F0 che costituisce il canale protonico è composto da 3 subunità a,b,c :
1 subunità a , 2 subunità b e le subunità c variano 10-12 a seconda dell’ organismo. Le due subunità b di F0 si associano alle subunità alfa e beta di F1 mantenendole fisse rispetto alla membrana. Al complesso F0 è legata la subunita gamma di F1 mediante la subunita ε.replica watches canada
La catalisi rotazionale
Le subunita beta del complesso F1 presentano ciascuna un sito attivo e catalizzano a turno la sintesi dell’ ATP. Tali subunita possono assumere 3 diverse conformazioni:
-conformazione beta-vuota con affinità molto bassa per l’ATP.
-conformazione beta-ADP che lega ADP e P
-conformazione beta-ATP che lega saldamente ATP.
Queste modificazioni sono accoppiate al flusso di ioni H+ attraverso F0. Il flusso di ioni H+, provoca la rotazione di F0 e della subunità gamma. Per ogni rotazione di 120° la subunità gamma entra in contatto con una subunita beta diversa.
Le 3 subunità Beta interagiscono tra di loro in modo che quando una assume la conformazione Beta vuota, le altre due devono assumere una la forma Beta ADP l'altra la forma Beta ATP. In questo modo per ogni rotazione completa di gamma quindi di 360° ogni subunità Beta compie un ciclo attraverso le tre possibili conformazioni. Per ciascuna rotazione vengono sintetizzate e rilasciate dalla superficie dell’enzima tre molecole di ATP.
In un determinato momento le tre subunità si presentano una in conformazione beta vuota, una in conformazione beta ATP e una in conformazione beta ADP. Il passaggio di protoni determina la rotazione della subunità gamma di 120° e questa entra in contatto con la subunità in conformazione beta ATP e la induce a trasformarsi nella conformazione beta -vuota che rilascia una molecola di ATP. Contemporaneamente la subunità che aveva Replica Uhren una conformazione Beta vuota assume la conformazione Beta ADP e lega ADP e P, mentre la subunità che aveva una conformazione Beta ADP viene convertita nella conformazione Beta ATP che promuove la condensazione di ADP e fosfato formando ATP. A questo punto il passaggio di altri protoni determina nuovamente la rotazione della subunità gamma di altri 120°. La subunità gamma si lega di nuovo alla subunità con conformazione beta-ATP e ne determina la conversione in conformazione Beta - vuota e avviene il rilascio di una seconda molecola di ATP. Contemporaneamente le altre due subunità così come è accaduto prima cambiano conformazione. Infine con il passaggio di altri protoni la subunità gamma ruota ancora di 120° tornando al punto di partenza e viene rilasciata la terza molecola di ATP. Con quest'ultima fase le 3 subunità hanno ciascuna assunto le tre diverse conformazioni.
Domenico Alberto